随着中国企业海外投资步伐的加快,越来越多的企业意识到海外投资,知产先行。目前大多数的国内企业注重境内知识产权保护体系搭建,但并未对其知识产权的境外保护给予足够的重视,导致一大批国内知名企业的企业名称、商标、著作权、专利、药品、医疗器械、医用耗材,在其不知情的情况下,被其他主体在境外国家注册。我们的部分客户在出海的过程中遇到了相关问题,采取事后的救济措施往往耗时极长,且在多数情况下,无法根本解决被抢注的问题。为此,天元广州知识产权部与涉外业务部通力合作,助力客户海外投资,知产先行,提前布局企业海外业务重点国家的知识产权申请。
天元近期已助力客户顺利完成包括坦桑尼亚、乌干达在内的境外多国知识产权申请。项目法律服务团队在收到客户境外多国知识产权申请委托后,在第一时间即启动相关知识产权的申请程序,并在最短的时间内,完成了知识产权预审、公布知识产权公告等步骤。

境外知识产权申请概览
1.海外商标申请的两种方式
(1)马德里商标国际注册途径
马德里商标国际注册,是指根据《商标国际注册马德里协定》和《商标国际注册马德里协定有关议定书》 及其《共同实施细则》规定,在马德里联盟成员间所进行的商标注册。国际局只起中转平台作用,即申请人通过国际局一并提交其向各个联盟成员国的商标注册申请,再由各成员国商标局依其法律审查是否给予注册保护,其实质上是为申请人提供了一个较为便利的申请渠道。截至目前,马德里联盟共有115个成员,覆盖131个国家。中国、美国、德国、法国、英国、意大利、日本、韩国、俄罗斯、澳大利亚、瑞士等世界主要经济体都是马德里联盟成员。
马德里商标国际注册具有覆盖范围广、手续方便快捷、费用相对低廉的优点,申请人只需一份申请即可指定几十个国家。通过马德里商标国际注册申请指定缔约方的商标保护大概需要18-24个月。一旦注册成功,商标的保护期限为10年。但其需要有国内商标注册基础。
(2)目标国直接申请途径
目标国直接提交商标注册申请也称单一国家注册申请,就是直接到拟申请保护的国家递交商标注册申请。该途径是最常见,申请数量最多的海外商标注册方式。其优点是便捷、灵活,可以随时启动;不需要以已经在国内获得注册为前提。缺点是当我们申请国家较多的时候,递交申请会相对繁琐一点;且不同国家注册所需时间差异较大,短的仅需半年左右,长的则需4-5年。
2.海外专利申请的三种途径
(1)《巴黎公约》途径
申请人在首次提出本国国家专利申请后12个月(发明或实用新型)/6个月(外观设计)内可直接向其他《巴黎公约》成员国(截至目前共180个成员)的专利主管机关分别提出申请,并要求享有优先权。
(2)《专利合作条约》(PCT)途径
申请人只需提交一件PCT 国际专利申请, 即可在众多成员国(截至目前共157个成员)中同时请求多国对其发明进行专利保护。专利权的授予仍由各国家或地区专利局负责,这称为“国家阶段”。PCT程序国际阶段耗时30个月左右;国家阶段,各国不同,中国国家阶段耗时2年左右。
(3)单一国家直接申请
申请人也可以就其发明创造直接在海外国家或地区提出专利申请。该方式为传统方式,适用于专利申请所涉及的国家较少的情况。
3. 国内作品著作权在国外的保护
《保护文学和艺术作品伯尔尼公约》(以下简称《伯尔尼公约》),是关于著作权保护的国际条约。中国是该公约成员国。目前,《伯尔尼公约》缔约方总数达到181个。《伯尔尼公约》采用自动保护原则和国民待遇原则,要求成员国相互承认版权的自动取得和平等保护,作者在成员国享受和行使版权无需履行任何手续,因此,包括中国、美国、韩国、日本和欧盟诸多国家或国家集团在内的《伯尔尼公约》成员均采用版权登记自愿原则,并不强制要求版权登记作为取得版权的依据。
需要注意的是,不同国家在著作权保护上也存在一些特殊要求和规定。比如,根据美国著作权法规定,登记不是受著作权法保护的条件,但是除特殊情况外,任何作品在依照该法进行著作权登记申请之前不得对著作权侵权行为提起诉讼。美国著作权法还规定只有登记才能获得法定赔偿。
4.企业的境外药品注册
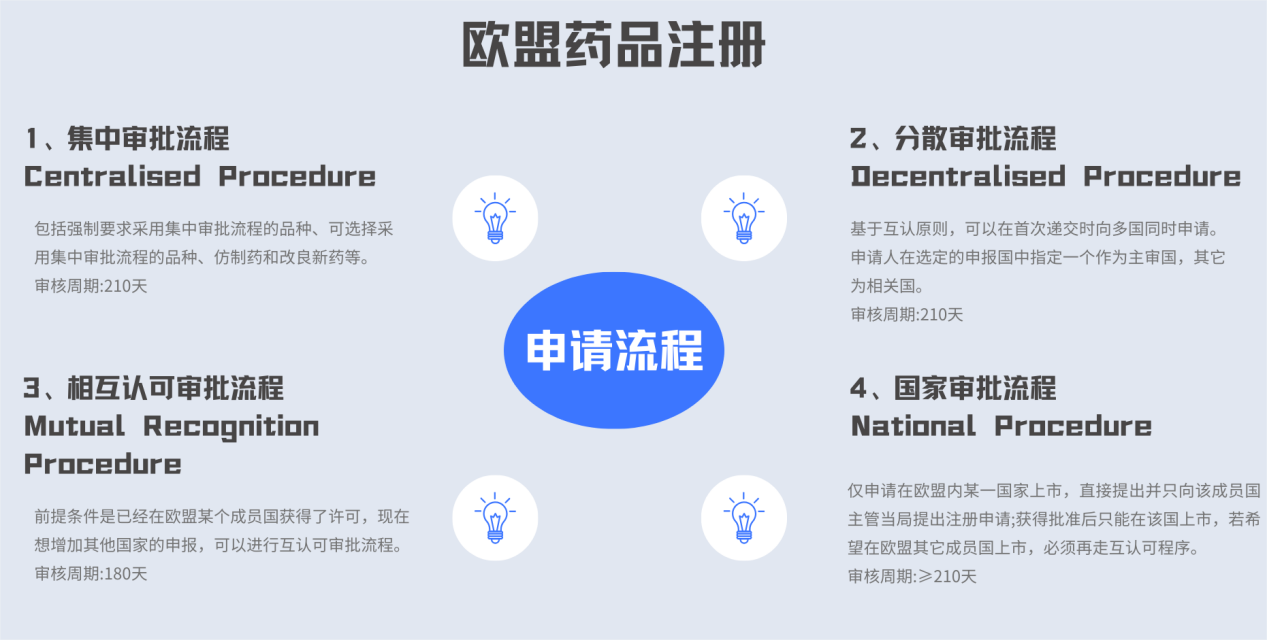
欧盟的药品上市申请有4种注册流程:1、集中审批流程(Centralised Procedure);2、分散审批流程(Decentralised Procedure);3、相互认可审批流程(Mutual Recognition Procedure);4、国家审批流程(National Procedure),各流程的适用范围如下:
中国企业在非洲主要国家注册药品的时间通常在1年到3年之间。注册时间受多种因素影响,包括药品的风险等级、所需的测试和临床数据、文件准备的完整性以及当地监管机构的审查效率。
需要注意,中国企业的境外药品注册有时会需要长达1至2年的工厂试验,才能取得批准。
5.医疗器械注册/医用耗材注册
美国医疗器械注册主要由美国食品药品监督管理局(FDA)负责。美国根据医疗器械的风险和为合理保证安全性和有效性所必需的监管控制将医疗器械分为三类, I 类、II 类或 III 类。I 类只需一般管理,可以豁免510(k);II 类, 特殊管理,需要获得510(k)或称上市通告;III 类, 特殊管理,必须获得上市许可(PMA)。整个注册周期在半年至一年左右。
中国企业在非洲主要国家进行医疗器械注册的时间通常在3到6个月之间。例如加纳,基于风险的分类模式,医疗器械将其分为 Class I、Class II、Class III、Class IV类。外国企业需完成Ghana FDA注册,方可进口。上市有效期为5年。注册周期参考:6个月。
- 相关领域
- 知识产权





